1-Ca lâm sàng
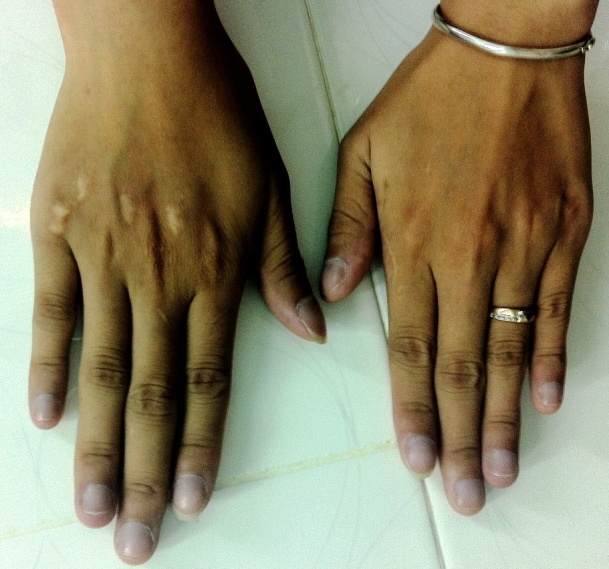
Bệnh nhân nữ 23 tuổi nhập viện vì được chẩn đoán bệnh tim bẩm sinh khi đang mang thai lần đầu tuần thứ 10. Về tiền sử, bệnh nhân chưa được chẩn đoán bệnh tim bẩm sinh trước đây, hiện sinh hoạt và lao động tương đối bình thường. Khám lâm sàng bệnh nhân có tím môi và đầu chi rõ (xem hình 1), SpO2 ( thở khí trời) là 85%, có tiếng thổi tâm thu khoang liên sườn 4-5 cạnh ức trái lan xung quanh, tiếng T2 rất mờ tại ổ van động mạch phổi.Về xét nghiệm , bệnh nhân không có tình trạng cô đặc máu (Hồng cầu 3.69 T/L, hematocrit 0.35, Hb 113g/l, tiểu cầu 247 G/l) .
Trên siêu âm tim, bệnh nhân được chẩn đoán teo tịt van động mạch phổi kèm thông liên thất (PA-VSD). Teo tịt van ĐMP, gốc động mạch phổi và phần lớn thân động mạch phổi; chỉ còn một phần thân động mạch phổi với hội lưu và hai nhánh động mạch phổi, còn ống động mạch, kích thước và chức năng tâm thu thất trái bình thường, đường kính thất phải bình thường, hở chủ nhẹ. Do PA-VSD là dị tật tim bẩm sinh phức tạp, bệnh nhân nếu mang thai nguy cơ cho cả mẹ và con đều rất cao, mặt khác trên lâm sàng bệnh nhân đã có tím và giảm độ bão hòa oxy máu do đó bệnh nhân có chỉ định đình chỉ thai.
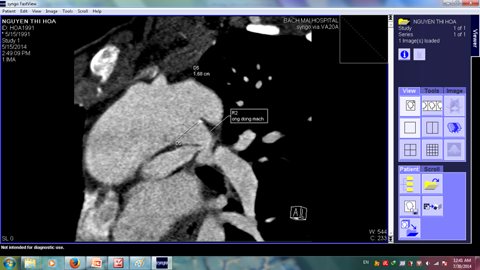
Sau đình chỉ thai, bệnh nhân đã được chụp MSCT hệ mạch phổi xem xét khả năng phẫu thuật sửa chữa toàn bộ. MSCT cho chẩn đoán PA-VSD, giãn nhẹ gốc động mạch chủ ( ĐK 45mm), động mạch phổi trái và phải có hội lưu chung, đường kính mỗi nhánh tương đối lớn ( 13 và 14 mm) , thân động mạch phổi rất ngắn, hẹp gốc động mạch phổi trái (Đk 5mm), không có tuần hoàn bàng hệ chủ phổi (MAPCAs), còn ống động mạch cấp máu cho hai phổi (Hình 2).
Hình 1: Tím đầu chi (ảnh chụp bàn tay bệnh nhân)
Hình 2: Hình ảnh chụp MSCT động mạch phổi cho thấy hai nhánh động mạch phổi phải và trái có hội lưu, hẹp gốc động mạch phổi trái (mũi tên trắng) và còn ống động mạch ( chú thích)
Bệnh nhân đã được phẫu thuật sửa chữa toàn bộ một thì bao gồm thắt ống động mạch, mở dọc hội lưu động mạch phổi vào nhánh trái đến hết chỗ hẹp, mở rộng hội lưu và nhánh trái bằng miếng vá màng ngoài tim, mở phần phễu thất phải vá lỗ thông liên thất, sau đó dùng một ống mạch nhân tạo không có van đường kính 18mm nối phần phễu thất phải với hội lưu động mạch phổi, mở một lỗ thông liên nhĩ nhân tạo đường kính 10mm.
Sau phẫu thuật, hồi sức cho bệnh nhân gặp rất nhiều khó khăn do tình trạng suy thất phải gây giảm cung lượng tim. Tình trạng bệnh nhân cuối cùng đã cải thiện, các dấu hiệu suy tim phải giảm dần, SpO2 cải thiện từ 85% trước mổ lên 94%, trên điện tâm đồ nhịp xoang đều không có các rối loạn nhịp, trên siêu âm tim (Hình 3) vách liên thất kín, động mạch chủ chỉ thông thương với thất trái, ống mạch nhân tạo thông tốt, không còn ống động mạch và có hình ảnh lỗ thông liên nhĩ nhân tạo shunt trái phải và bệnh nhân đã được xuất viện.
Câu hỏi đặt ra:
- Về hướng xử trí đã tiến hành trên bênh nhân: Phẫu thuật sửa chữa toàn bộ một thì có nên tiến hành khi bệnh nhân này đã ở độ tuổi trưởng thành và triệu chứng cơ năng không rõ ràng? Tại sao khi phẫu thuật sửa toàn bộ, bệnh nhân này không được dùng đoạn mạch nhân tạo có van? Vai trò của lỗ thông liên nhĩ nhân tạo là gì?
- Về hướng quản lý điều trị tiếp theo: Các triệu chứng và thông số theo dõi lâu dài cho bệnh nhân này là gì? Bệnh nhân có thể mang thai sau khi đã sửa chữa toàn bộ?
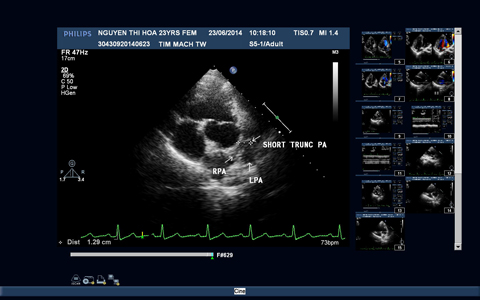
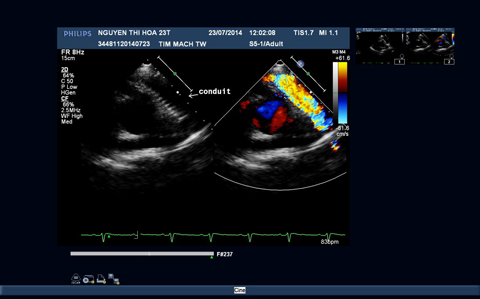
Hình 3: Hình ảnh siêu âm tim trước và sau phẫu thuật
3A: Mặt cắt trục ngang cạnh ức trái cho hình ảnh động mạch phổi chỉ có một phần hội lưu và hai nhánh động mạch phổi.
3B: Hình ảnh đoạn mạch nhân tạo thông tốt giữa thất phải và hội lưu động mạch phổi.
=
2-Tổng quan
Teo tịt động mạch phổi kèm thông liên thất ( PA-VSD) là dạng tổn thương tim bẩm sinh phức tạp hiếm gặp được đặc trưng bởi:
- Không liên tục của cấu trúc hoặc dòng máu nối từ buồng thất phải đến cây động mạch phổi ( Teo tịt động mạch phổi –PA)
- Dị tật thông liên thất ( VSD) và
- Tim hai buồng thất
Tỷ lệ mắc PA-VSD ước tỉnh khoảng 0.07 trong 1000 trẻ sinh sống, chiếm khoảng 1% tổng số các dị tật tim bẩm sinh. Trong nhóm tứ chứng Fallot, teo tịt động mạch phổi chiếm khoảng 12%.
Do teo tịt của lỗ van động mạch phổi nên dòng tưới máu cho phổi đến từ các nguồn thay thế như các động mạch bàng hệ chủ phổi (MAPCAs), ống động mạch ( PDA) hoặc kết hợp cả hai nguồn này. Dựa theo mức độ thiểu sản của thân nhánh động mạch phổi, và nguồn cấp máu thay thế cho phổi mà PA-VSD được chia thành các típ khác nhau (Hỉnh4).
Về điều trị, phẫu thuật là cần tiến hành sớm có thể là phẫu thuật tạm thời hoặc sửa chữa toàn bộ, một thì hoặc nhiều thì phụ thuộc vào mức độ thương tổn với mục đích cuối cùng là:
- Tạo sự tưới máu phổi không tắc nghẽn, không phụ thuộc hệ tuần hoàn chủ
- Thiết lập sự thông thương giữa thất phải và các động mạch phổi
- Sửa chữa các thương tổn trong tim
Về tiên lượng, nếu không được điều trị thì kỳ vọng sống của những bệnh nhân này rất xấu, tỷ lệ tử vong khoảng 50% trong năm đầu đời, tăng lên 92% tại thời điểm 10 năm. Tuy nhiên, cũng có bệnh nhân không được phẫu thuật có thể sống đến tuổi 60 do giường mạch phổi được cấp máu bởi tuần hoàn bàng hệ. Tỷ lệ sống sót ước tính sau sửa chữa toàn bộ vào khoảng 92% sau 5 năm, 86% sau 10 năm, 75% sau 20 năm. Nhóm bệnh nhân được phẫu thuật tạm thời như dự đoán có tiên lượng xấu hơn nhóm được sửa chữa toàn bộ, với tỷ lệ sống sót ước tính khoảng 83% trong 4 năm, 73% trong 10 năm, 61% trong 15 năm và 61% trong 20 năm.
Hình 4: Phân loại các típ PA-VSD
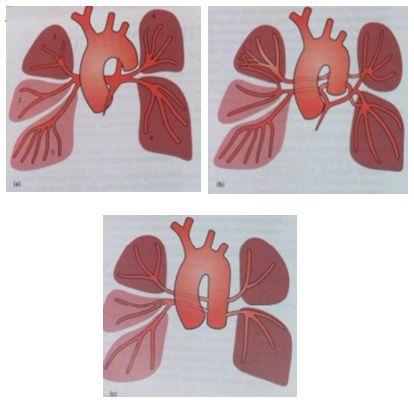
- Típ 1: Các nhánh động mạch phổi trung tâm kích thước bình thường, tưới máu tốt cho nhu mô với nguồn cấp máu từ ống động mạch.
- Típ 2: Tồn tại các nhánh động mạch phổi trung tâm nhưng thiểu sản và xuất hiện động thời MAPCAs.
- Típ 3: Các nhánh động mạch phổi trung tâm hoàn toàn không tồn tại và phổi được cấp máu toàn bộ bởi MAPCAs
3-Biểu hiện lâm sàng
Do sự khác biệt lớn giữa các cá thể mang bệnh, phụ thuộc vào cấp máu phổi và các nhánh tuần hoàn bàng hệ, ba dạng biểu hiện bệnh được quan sát bao gồm:
Những bệnh nhân cấp máu phổi phụ thuộc hoàn toàn vào ống động mạch sẽ xuất hiện tím khi ống động mạch đóng. Nhóm bệnh nhân này cần được truyền prostaglandin E1 đế duy trì sự tồn tại của ống, trước khi phẫu thuật làm cầu nối chủ phổi.
Những bệnh nhân được cấp máu phổi một phần hoặc hoàn toàn từ MAPCAs có được lượng máu lên phổi tương đối đầy đủ thời niên thiếu và thường không có triệu chứng. Tuy nhiên với những trẻ có tuần hoàn bàng hệ không phát triển hoặc các nhánh bàng hệ này bị hẹp dần, trẻ sẽ xuất hiện triệu chứng tím tăng dần.
Những bệnh nhân có các MAPCA lớn và dòng máu lên phổi không hạn chế xuất hiện phù phổi khi sức cản mạch phổi giảm thời kỳ sơ sinh. Những trẻ này cần được diều trị suy tim sung huyết và có nguy cơ hình thành bệnh lý mạch máu phổi sau này.
4-Điều trị
Do sự đa dạng phức tạp của tuần hoàn mạch phổi nên không có đồng thuận cho chiến lược điều trị tối ưu ở bệnh nhân PA-VSD, chỉ có một vài tiếp cận điều trị được đề xuất. Tuy nhiên do hạn chế về kỹ thuật nên rất ít khi tái lập được tuần hoàn phổi bình thường. Hơn nữa, các nguy cơ của can thiện cần được cân bằng với diễn biến tự nhiên của bệnh. Trong tất cả các trường hợp, cần cá thể hóa điều trị với mỗi bệnh nhân dựa trên tổn thương giải phẫu và biểu hiện lâm sàng.
4.1 Điều trị phẫu thuật
4.1.1 Sửa chữa tuần hoàn phổi
Những bệnh nhân có các nhánh động mạch phổi trung tâm phát triển tốt, có hội lưu động mạch phổi và dòng máu lên phổi phụ thuộc vào ống động mạch thường có tiên lượng tốt nhất trong nhóm và thường không cần tái cấu trúc hệ mạch phổi. Trái lại, tạo dựng hệ tuần hoàn phổi độc lập ở những bệnh nhân phụ thuộc MAPCA gặp khó khăn nhiều nhất. Điều này đạt được khi tập trung tất cả các nguồn tưới máu phổi cung cấp bởi MAPCAs thành một nhánh trung tâm duy nhất ( Quy tập các MAPCA - Unifocalisation). Trong phẫu thuật tập trung này, các MAPCAs được cắt rời khỏi động mạch chủ. Các đầu cắt rời này được nối lại với nhau thành một miệng nối duy nhất, để sau đó nối với các nhánh động mạch phổi tự nhiên.
Thời điểm tiến hành phẫu thuật này vẫn còn tranh cãi. Lý tưởng nhất, thủ thuật được tiến hành trước khi có biểu hiện hẹp của MAPCAs, trước khi hình thành bệnh lý mạch máu phổi và khi bệnh nhi đủ lớn để chịu đựng cuộc mổ và nguy cơ phẫu thuật thấp nhất. Phần lớn bệnh nhân có thể chịu được cuộc phẫu thuật qui tập các nhánh MAPCA khi còn nhỏ.
4.1.2 Hình thành thông thương động mạch phổi- thất phải
Tạo lập sự liên tục của dòng máu giữa thất phải và động mạch phổi có thể đạt được bởi sử dụng:
- Một đoạn mạch đồng loài hoặc khác loài. Việc tạo lập một đoạn mạch nối sớm sẽ thúc đẩy sự phát triển của mạch máu phổi, nhưng bất lợi là đoạn mạch này cần tái thay thế nhiều lần.
- Mở rộng đường ra thất phải bằng miếng vá nhân tạo khi phần phễu thất phải và thân chung động mạch phổi kích thước đủ lớn.
- Dùng năng lượng cao tần đường ống thông đục thủng vùng van động mạch phổi teo tịt sau đó đặt stent vào đường ra thất phải (chỉ teo tịt van động mạch phổi, gốc – thân – hội lưu và hai nhánh động mạch phổi bình thường). Kỹ thuật này hiện đang được thử nghiệm.
4.1.3 Sửa chữa các thương tổn trong tim
Nếu các MAPCAs được quy tập đủ để tạo tuần hoàn phổi kèm sức cản phổi đủ thấp, khi đó phẫu thuật vá thông liên thất và sửa chữa các tổn thương trong tim trở nên dễ dàng. Tuy nhiên, nếu số lượng các phân thùy phổi được tưới máu từ các MAPCA đã được quy tập, ít hơn 14 trong số 18-20 phân thùy, hoặc sự phân nhánh tưới máu ngoại vi phổi bất thường nghiêm trọng, sức cản phổi tăng cao, việc đóng lỗ thông liên thất là không thể. Tỷ lệ áp lực ước tính giữa thất phải : thất trái nên nhỏ hơn 0.7-0.8 trước khi tiến hành đóng VSD.
4.2 Điều nội khoa và theo dõi sau phẫu thuật
4.2.1Những bệnh nhân đã được phẫu thuật sửa chữa toàn bộ
Tiếp cận nhóm bệnh nhân này cần tập trung vào xác định các biến chứng muộn, phòng ngừa rối loạn chức năng thất và rối loạn nhịp. Các thăm dò cần tiến hành bao gồm:
- Khám lâm sàng ( Xem bảng1: các thông số cần theo dõi)
- Điện tâm đồ để sàng lọc các rối loạn nhịp và theo dõi độ rộng của phức bộ QRS
- XQ tim phổi- Xác định tình trạng canxi hóa ống thông nhân tạo thất phải-động mạch phổi, bóng tim to, sự tưới máu phổi.
- Holter điện tâm đồ- nếu nghi ngờ rối loạn nhịp
- Test gắng sức- ghi nhận khả năng gắng sức
- Siêu âm Doppler tim- đánh giá tình trạng hẹp hay trào ngược lòng ống nhân tạo, lượng giá chức năng và áp lực thất phải, đo kích thước gốc động mạch chủ, mức độ hở chủ, quan sát miếng vá thông liên thất và tìm kiếm các luồng thông trong tim
- Thông tim cho những bệnh nhân chọn lọc có triệu chứng, những bệnh nhân mà có thể tiến hành can thiệp đường ống thông. Đo áp lực thất phải, động mạch phổi và chụp hình cây động mạch phổi đánh giá tình trạng hở phổi. Nếu nghi ngờ còn MAPCAs tồn dư, chỉ định chụp động mạch chủ xuống và chọn lọc các nhánh bàng hệ. Chụp buồng thất trái, thất phải để lượng giá chức năng hai thất. Chụp mạch vành nếu có nghi ngờ bệnh lý.
- Cộng hưởng từ tim và chụp mạch- tiến hành ở nhóm bệnh nhân chọn lọc có triệu chứng để dựng hình cây động mạch phổi, mô tả các MAPCA, đánh giá mức độ hở phổi và chức năng hai thất.
4.2.2.Những bệnh nhân được sửa chữa tạm thời hoặc không phẫu thuật
Nhóm bệnh nhân này cần được khám tỷ mỷ khi có các triệu chứng để xác định khả năng can thiệp. Các thăm dò bao gồm siêu âm tim, thông tim, chụp MRI tim. MRI đặc biệt hữu ích để dựng hình giải phẫu cây động mạch phổi và quan sát tốt các nhánh động mạch phổi đoạn gần. Mục đích của thăm dò hình ảnh gồm:
- Đánh giá chức năng hai thất
- Đánh giá áp lực thất phải và động mạch phổi
- Mô tả đặc trưng giải phẫu của cây động mạch phổi. Mô tà này cần dựa trên chụp động mạch phổi ( nếu thông thương thất phải và động mạch phổi), chụp các luồng thông, chụp động mạch chủ xuống và chụp chọn lọc các MAPCA. Trong vài trường hợp, chụp tĩnh mạch phổi bít hoặc MRI tim với gadolium là cách duy nhất để dựng hình khi các mạch máu phổi tự nhiên không hợp lưu hoặc bị thiểu sản.
- Xác định lỗ thông liên thất nếu có
- Đánh giá động mạch vành
Với những bệnh nhân tím có triệu chứng có thể thăm dò sâu hơn các biến chứng của thiếu oxy mạn tính kéo dài như đa hồng cầu, thiếu sắt và tăng acid uric máu.
BẢNG 1: CÁC THÔNG SỐ CẦN THEO DÕI
Các bệnh nhân đã được sửa chữa
- Các bệnh nhân này nên có mức bão hòa oxy máu bình thường
- Rung mưu, thổi tâm thu tống máu, tiếng T2 mạnh hay gặp ở những bệnh nhân có ống nối nhân tạo thất phải- động mạch phổi
- Tiếng thổi dội đi dội lại vùng ống nhân tạo có gợi ý sự trào ngược ống đáng kể
- Tiếng thổi tâm trương có thể do hở chủ
- Tiếng thổi liên tục đặc biệt sau lưng hoặc thành bên ngực gợi ý tồn tại các MAPCAs hoặc các luồng thông hình thành khi mổ.
Các bệnh nhân chưa được mổ hoặc phẫu thuật tạm thời
- Giảm bão hòa oxy là thường gặp và là điều không mong muốn
- Tiếng thổi liên tục đặc biệt sau lưng hoặc thành bên ngực gợi ý tồn tại các MAPCAs hoặc các luồng thông hình thành khi mổ.
- Ở những bệnh nhân được xác định tồn tại MAPCAs trước đó, việc biến mất của tiếng thổi dự báo hình thành tăng áp phổi
- Các dấu hiệu của suy tim phải có thể xuất hiện: tĩnh mạch cổ nổi, phù, gan to
5-Bàn luận ca lâm sàng
Về chẩn đoán, PA-VSD là một dị tật tim bẩm sinh phức tạp chỉ chiếm 1- 2% tổng số ca tim bẩm sinh người lớn. Trên 90% bệnh nhân đã tử vong trong 10 năm đầu đời nếu không được phẫu thuật. Vì vậy, dữ liệu về bệnh nghèo nàn, không có đồng thuận cho điều trị. Hạn chế về kinh nghiêm dẫn đến việc chẩn đoán và đưa ra chiến lược điều trị cho ca bệnh 23 tuổi này gặp nhiều khó khăn.
Việc mang thai khi đã có triệu chứng tím, giảm độ bão hòa oxy máu ( 85%) gây nguy hiểm cho cả mẹ và con vì vậy chỉ định đình chỉ thai nghén ở bệnh nhân này là không bàn cãi. Tuy nhiên câu hỏi đặt ra là có nên phẫu thuật sửa chữa toàn bộ ở độ tuổi này khi triệu chứng cơ năng không đáng kể?
Chụp MSCT cho kết quả kích thước các nhánh động mạch phổi khá tốt, có hội lưu, không có MAPCA tưới máu phổi (nguồn cấp máu phổi là từ ống động mạch qua hệ mạch phổi tự nhiên). Kết hợp với chức năng thất trong giới bình thường, hở van động mạch chủ nhẹ, ống động mạch shunt T-P trên siêu âm, đây là thể PA-VSD có tiên lượng tốt nhất trong các thể PA-VSD nên chúng tôi đã quyết định phẫu thuật sửa chữa toàn bộ, để cải thiện tiên lượng xa và có thể đáp ứng nguyện vọng mang thai của bệnh nhân sau này.
Trong phẫu thuật, việc phẫu tích mở rộng vùng hội lưu động mạch phổi lên nhánh động mạch phổi trái và tạo hình bằng miếng vá màng ngoài tim không dễ dàng do trường mổ sâu, đoạn gốc động mạch phổi trái hẹp rất khít (Đk 5mm). Đoạn mạch nhân tạo phù hợp với các nhánh động mạch phổi tự nhiên đường kính nhỏ (18mm) cộng với các nhánh mạch phổi tự nhiên và đoạn mới tạo hình kích thước không thể lớn như động mạch bình thường nên phẫu thuật viên quyết định dùng đoạn mạch không có van đến giảm hiện tượng chênh áp lớn giữa thất phải- đoạn mạch nhân tạo sau này. Về lâu dài, bệnh nhân có thể có nguy cơ suy tim phải do hiện tượng trào ngược trong đoạn mạch nhân tạo không có van này. Sau khi vá thông liên thất, nối đoạn mạch nhân tạo, phục hồi tuần hoàn từ thất phải lên động mạch phổi, huyết áp bệnh nhân rất thấp không dừng được tuần hoàn ngoài cơ thể do giảm cung lượng, phẫu thuật viên đã quyết định mở lỗ thông liên nhĩ nhân tạo nhằm tạo luồng thông trái phải, làm tăng máu lên phổi, tăng lượng máu về thất trái. Kết quả bệnh nhân có huyết động và ngừng được máy.
Về theo dõi sau mổ, bệnh nhân này cần được theo dõi sát các dấu hiệu như miêu tả trong mục tổng quan đặc biệt là tình trạng suy tim phải và các rối loạn nhịp do trong giai đoạn hồi sức, tình trạng suy tim phải ở bệnh nhân này rất nặng nề. Bệnh nhân cần được đánh giá lại tình trạng lưu thông máu qua nhánh trái đã sữa chữa và hội lưu động mạch phổi, cũng như sự phát triển của các nhánh động mạch phổi phía ngoại vi. Chỗ hẹp tồn lưu của động mạch phổi trái có thể cải thiện bằng can thiệp nong bóng đường ống thông. Nếu chức năng thất phải bị ảnh hưởng do dòng hở phổi nghiêm trọng thì kỹ thuật thay van động mạch chủ qua da hoặc thay đoạn mạch mới có van có thể cải thiện tình trạng này.
Về khả năng sinh nở, nếu sau 6 tháng đến 1 năm, tình trạng tim mạch ổn định, bệnh nhân có thể mang thai với nguy cơ thấp tương tự như nhóm bệnh nhân Fallot 4 đã được sửa chữa toàn bộ. Lưu ý, cần theo dõi sát tình trạng suy tim sung huyết, huyết khối, rối loạn nhịp cho mẹ trong thai kỳ. Nếu được cần chẩn đoán di truyền cho mẹ do một tỷ lệ lớn PA-VSD nằm trong hội chứng Di-George và sàng lọc sớm các dị tật cho thai.
6-Tóm lại
Mặc dù teo tịt van động mạch phổi kèm thông liên thất có chung dạng tổn thương giống tứ chứng Fallot, nhưng bất thường phức tạp của hệ mạch phổi và tưới máu phổi gây rất nhiều khó khăn cho điều trị. Tỷ lệ sống sót nếu bệnh nhân không được phẫu thuật rất thấp. Điều trị phẫu thuật rất đa dạng tùy thuộc vào mức độ phức tạp của tuần hoàn tưới máu phổi. Can thiệp ngoại khoa có thể chỉ đơn giản tạo ống nối giữa thất phải và động mạch phổi hay phức tạp hơn nhiều với kỹ thuật quy tập các nhánh động mạch phổi phân thùy thành một gốc duy nhất trước khi sử dụng ống nối nhân tạo.Ống nối nhân tạo thất phải- động mạch phổi thường phải thay thế nhiều lần. Tử vong và các tình trạng bệnh lý phụ thuộc vào mức độ phức tạp về giải phẫu tổn thương, sự hoàn thiện trong sửa chữa và chức năng thất phải.