Kể từ khi Jean Dauset lần đầu tiên phát hiện kháng nguyên bạch cầu người vào năm 1958, lĩnh vực nghiên cứu Kháng nguyên bạch cầu người (Human Leucocyte Antigen, HLA) bắt đầu khởi động và phát triển rất nhanh. Hơn 50 năm qua, hiệp hội quốc tế về kháng nguyên phù hợp tổ chức (International Histocompatibility Workshop and Conference, IHWC) đã trải qua 13 lần đại hội, nhiều nghiên cứu đã được báo cáo, bao gồm về cấu trúc phân tử, chức năng sinh học, các kỹ thuật phân tích, xác định HLA, mối liên hệ giữa hệ HLA với một số bệnh tật, các ứng dụng hay ý nghĩa lâm sàng của nghiên cứu HLA trong y học, trong pháp y…[1], [2].
1. SƠ LƯỢC VỀ HỆ THỐNG KHÁNG NGUYÊN BẠCH CẦU NGƯỜI HLA
1.1. Sơ lược về hệ thống HLA
Phức hợp kháng nguyên phù hợp tổ chức của người MHC (Major Histocompatibility Complex) hay còn được gọi là Kháng nguyên bạch cầu người (Human Leucocyte Antigen, HLA) do lần đầu tiên phát hiện được ở trên tế bào bạch cầu. Các kháng nguyên phù hợp tổ chức chính của người là các kháng nguyên trong hệ thống phù hợp tổ chức HLA là các kháng nguyên bề mặt bạch cầu người. Kháng nguyên HLA lần đầu tiên được phát hiện khi nghiên cứu hiện tượng thải ghép. Khi cấy mô ghép cho một cơ thể khác không giống nhau về các kháng nguyên này (tức là không hòa hợp với tổ chức) thì chúng sẽ kích thích cơ thể nhận đáp ứng miễn dịch, dẫn đến thải bỏ mô ghép [1], [2].
Các gen của HLA nằm trên đoạn ngắn của nhiễm sắc thể số 6, chiều dài tổng cộng là 3.600kb hoặc 4,6 x 106 bazơ nitơ, bao gồm 224 alen, trong đó có 128 alen có chức năng và 96 alen không có chức năng. Cho đến nay, HLA được coi là hệ kháng nguyên của người phức tạp nhất và đa hình (polymorphism) nhất).
Các MHC gồm 2 loại protein gọi là protein MHC lớp I và protein MHC lớp II. Cả 2 loại phân tử lớp I và lớp II đều là các glycoprotein bề mặt làm nhiệm vụ nhận diện kháng nguyên. Những kháng nguyên MHC lớp I có trên bề mặt ở tất cả các tế bào có nhân ở động vật có xương sống, còn protein MHC lớp II chỉ có trên bề mặt của một số loại tế bào như tế bào B, đại thực bào và các tế bào trình diện kháng nguyên viết tắt là APCs (Antigen Presenting Cells) giúp tế bào B tạo kháng thể [7], [12].
Hình 1. Các locus gen trong hệ thống HLA
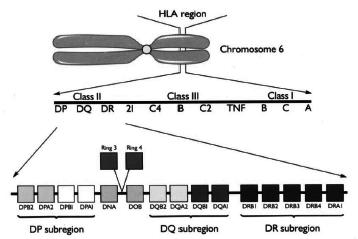
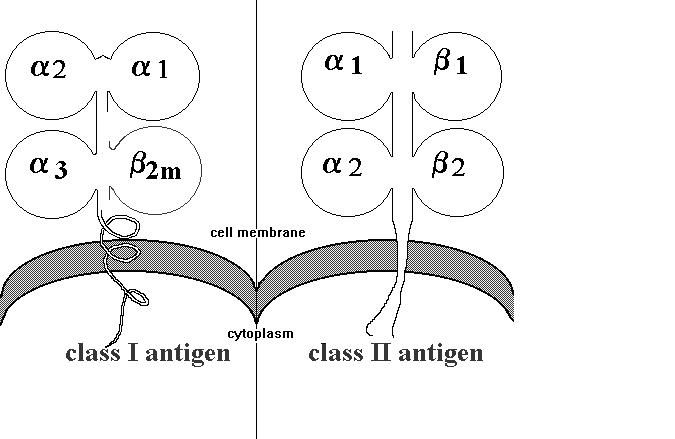
Người ta đã xác định được hệ thống các gen HLA nằm trên nhánh ngắn nhiễm sắc thể số 6 với trên 200 gen khác nhau nằm trên vùng 4Mb. Ở đây có hai hệ thống locus gen đa alen. MHC lớp I có 3 locus (HLA-A, -B, và -C). Trong đó HLA-A có 207 alen, HLA-B có 412 alen và HLA-C có 100 alen. Protein MHC lớp I có cấu tạo gồm 2 chuỗi polypeptid. Một chuỗi là glycoprotein có tính đa hình cao - chuỗi a cắm sâu vào màng sinh chất; chuỗi kia là microglobulin b-2 (viết tắt là b2m)
không có tính đa hình, đây là một polypeptid nhỏ hơn nhiều so với chuỗi a, chúng gắn với các peptid ngoại lai chưa qua chế biến có nguồn gốc trong tế bào (peptid virus), giúp trình diện kháng nguyên cho tế bào T CD8+ phản ứng lại một số virus khi chúng xâm nhập vào cơ thể. Các locus MHC lớp I khác ít tính đa hình hơn. Các HLA lớp I có ý nghĩa nhiều trong ghép mô, ghép tạng chủ yếu là các locus HLA-A, HLA-B, và một số locus HLA-C. Mỗi locus này có hàng chục alen khác nhau tạo nên tính đa dạng cao giữa các cá thể [17], [18].
MHC lớp II có 11 hệ thống locus thuộc HLA-DR, HLA-DM, HLA-DQ và HLA-DP.
Trong đó:
HLA-DR: Gồm HLA-DRA, HLA-DRB1, HLA -DRB (HLA -DRB3/ HLA -DRB4);
HLA-DM: Gồm HLA-DMA, HLA-DMB;
HLA-DQ: Gồm HLA-DQA1, HLA-DQB1, HLA-DQB5;
HLA-DP: Gồm HLA - DPA1, HLA-DPB1.
Protein MHC lớp II cũng có bản chất glycoprotein, gồm (HLA-DR, HLA -DQ, và HLA - DP) cũng có cấu tạo từ 2 chuỗi polypeptid là a và b glycoprotein có dạng heterodimer có trên bề mặt tế bào trình diện kháng nguyên- tế bào B. Các phân tử MHC lớp II gắn với các peptid đã qua chế biến có nguồn gốc chủ yếu protein màng tế bào và ngoại bào (như peptid vi khuẩn) và trình diện cho tế bào T CD4+. Các polypeptid đều cắm sâu vào màng sinh chất và nhô ra ngoài mặt tế bào. Cả hai vùng HLA-DQ và HLA -DP đều chứa 5 gen. HLA-DP chứa 2 gen b và 3 gen a. HLA- DQ chứa 3 gen b và 2 gen a. Trong đó có 2 gen chức năng mã hóa cho chuỗi a (DQA1 và DPA1) và chuỗi b (DQB1 và DPB1). Ngoài ra, còn một số gen giả là DQA2, DQB2, DPA2 và DPB2. Vùng HLA-DR chứa 4 gen gồm 3 gen b và 1 gen a. Các gen này mã hóa cho chuỗi b (DRA) và a (DRA). Các locus MHC lớp II cũng có tính đa hình cao tới hàng trăm alen khác nhau [1], [2].
Hình 2. Cấu trúc protein của hai lớp MHC
Xen kẽ hai hệ thống locus trên còn có các hệ thống locus khác như xen giữa gen lớp I và lớp II còn có gen lớp III (gen bổ thể). Giữa các gen lớp III còn có gen CYP21A và CYP21B mã hóa cho tổng hợp hormone tuyến thượng thận. Các gen HLA đều đồng trội, liên kết chặt chẽ và di truyền cùng nhau. Chính vì vậy, khả năng tìm được hai người có sự phù hợp HLA là rất khó, có thể gặp ở hai người có cùng huyết thống. Vì thế đây là các hệ thống gen có ý nghĩa đặc biệt quan trọng trong việc thải trừ các mô ghép do chúng kiểm soát việc tổng hợp nên các kháng nguyên bề mặt tế bào bạch cầu của người dưới dạng các chuỗi polypeptid cắm sâu vào màng sinh chất và nhô ra ngoài bề mặt tế bào [1], [2].
1.2. Chức năng của hệ thống HLA trong cơ thể
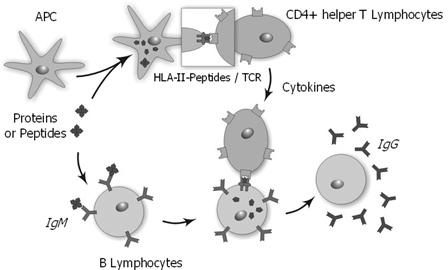
Khởi đầu sự phát hiện ra hệ HLA là trong quá trình nghiên cứu sự thải ghép. Hệ gien HLA với các sản phẩm phiên mã của mình tham dự với những mức độ khác nhau vào quá trình nhận diện miễn dịch, đáp ứng miễn dịch và điều hòa miễn dịch của cơ thể, đó là: Tham dự vào đáp ứng miễn dịch với tế bào lympho T; tham dự vào kiểm soát di truyền các đáp ứng miễn dịch; liên kết các hoạt động của các tế bào miễn dịch; tham dự vào quá trình xử lý kháng nguyên; tham dự vào quá trình điều biến miễn dịch; tham dự vào quá trình phânhóa các tế bào miễn dịch… Các bạch cầu của một cơ thể được dán nhãn hiệu cá nhân để phân biệt tế bào đó là của mình hay của kẻ khác. Nhãn hiệu này được đóng vào màng tế bào, gồm nhiều protein có cấu tạo đặc biệt, không ai giống ai. Protein này được tạo thành bởi các cặp gen nằm trên nhiễm sắc thể số 6 trong nhân tế bào. Những cấu trúc gien này được gọi là hệ HLA, là bộ tham mưu chỉ huy các lực lượng an ninh cơ thể. Nhờ nó, khi kẻ lạ vào người, các bạch cầu nhận dạng được ngay và báo động. Cuộc chiến tranh tự vệ sẽ nổ ra nhằm tiêu diệt vi trùng xâm lược hoặc làm bong những mảng tế bào lạ, những mô lạ ghép vào túc chủ [1], [2], [5], [7].
Nếu hệ HLA bị hỏng (hay có những vấn đề về hoạt động bình thường, nghĩa là rối loạn), không nhận ra kẻ thù thì các tác nhân gây bệnh và các mô lạ (như khối u, tế bào nhiễm virut...) tha hồ tàn phá cơ thể. Đôi khi có loại virus xảo quyệt đến mức chui vào tế bào mà không làm mất nhãn hiệu của tế bào, khiến hệ HLA mất cảnh giác, chỉ vì không nhận diện nổi kẻ ngoại lai.
Cũng có khi hệ HLA đánh vào một số tế bào của cơ thể đã để mất nhãn hiệu. Những tế bào này đã bị coi là kẻ phản bội, “ta” đã biến thành thù. Trong trường hợp này xảy ra tình trạng bệnh tự miễn dịch [2], [12].
Hình 3. Quá trình đáp ứng miễn dịch và vai trò của HLA-II
1.3. Liên quan giữa HLA và bệnh tật
Rất lâu trước khi vai trò trình diện kháng nguyên của MHC được khám phá, người ta thấy có sự phổ biến của một số bệnh tự miễn với một vài kiểu hình HLA. Sự liên hệ này đã được khẳng định qua các nghiên cứu trong các dòng họ hoặc trong các cộng đồng dân cư. Người ta đã tính được nguy cơ tương đối (RR: Relative risk hoặc risk ratio) của một số bệnh có liên quan đến HLA. Ngược lại, một số kiểu hình HLA lại có tính chất "bảo vệ" (RR < 1). Cơ chế về sự liên quan giữa một số allele HLA và bệnh tự miễn vẫn chưa được hiểu rõ, hiện có 3 giả thuyết để giải thích [2], [7], [12]:
(1) Các alen đó trình diện quá mức 1 kháng nguyên tự thân.
(2) Các alen mã hóa các phân tử MHC kém chất lượng, dẫn đến dễ mắc bệnh, mạn tính hóa và tự miễn hóa.
(3) Cơ chế gián tiếp: Các alen gây bệnh không phải là bản thân HLA mà là 1 gen ở vị trí lân cận và biểu hiện đồng thời.
Hệ HLA có liên quan đến một số bệnh di truyền liên quan với các gen liên kết HLA như hội chứng tăng sản thượng thận bẩm sinh liên quan đế enzym 21 hydroxylase do đột biến gen CYP21A, CYP21B. Bệnh viêm cột sống dính khớp liên quan tới HLA-B27 ở 90% các trường hợp, trong khi ở nhóm chứng chỉ là 9,4%. Tần suất DR5 ở bệnh nhân viêm đa khớp dạng thấp là 50%, trong khi ở nhóm chứng là 16,2% [1], [2], [3], [5].
Sự tương hợp giữa nhóm máu và bệnh có liên quan đến không chỉ ở hệ thống ABO mà còn ở các hệ thống khác. Trong thời gian gần đây sự nghiên cứu mạnh mẽ theo phương hướng nàyđược tiến hành với hệ thống HLA. Một trong các mối tương tác mạnh nhất đã được nghiên cứulà sự tương hợp của kháng nguyên HL-A W27 với các bệnh viêm cứng khớp sống, bệnh Reiter, bệnh vẩy nến, viêm gan mãn, luput ban đỏ hệ thống, nhược cơ…[1], [2], [3], [5].
Một số nghiên cứu cũng đưa ra mối liên quan về việc mang các alen HLA-DQA1 cũng ảnh hưởng đến nguy cơ bị ung thư gan nguyên phát hay ung thư phổi [4].
Hệ HLA cũng có liên quan với cả những bệnh nhiễm khuẩn hay nhiễm virus như nhiễm virus viêm gan B, C và nhiễm HIV, các nhiễm khuẩn như Helicobacter pylori... Nhiều nghiên cứu nhận thấy rằng, những người mang alen HLA-Bw54 thường có tỷ lệ mang HbsAg rất cao so với những nhóm người khác, đặc biệt là ở nam giới. Những người mang alen HLA-DR13 thì lại có khả năng loại trừ kháng nguyên HbsAg rất nhanh sau khi bị Viêm gan do virus B cấp tính. Những người mang alen HLA-DR (đặc biệt là mang alen HLA-DR*0103, HLA-DR*0104 thì ít có xu hướng chuyển sang Viêm gan mạn tính [1], [2], [3], [25], [26].
2. HỆ THỐNG HLA VÀ BỆNH TĂNG HUYẾT ÁP NGUYÊN PHÁT
Năm 1975, Low B và cộng sự [16] khi tiến hành thí nghiệm độc tế bào Lympho xác định kháng nguyên HLA để nghiên cứu mối liên hệ giữa HLA với bệnh tăng huyết áp nguyên phát và bệnh đái tháo đường mang tính chất gia đình đã phát hiện trong số 27 trường hợp tăng huyết áp nguyên phát có 41% người bệnh mang HLA-B8, kể từ đó nhiều tác giả đã bắt đầu quan tâm nghiên cứu mối liên quan giữa HLA và bệnh tăng huyết áp nguyên phát. Bằng các xét nghiệm huyết thanh học và sinh học phân tử, nhiều nghiên cứu của nhiều tác giả đã đưa ra nhiều nhận xét về mối liên quan giữa hệ HLA với bệnh tăng huyết áp nguyên phát. Năm 1981 Johnson J [13] và cộng sự sử dụng phương pháp độc tế bào Lympho để nghiên cứu hệ HLA trên người da đen, nghiên cứu phân tích sự phân bố HLA- A và HLA - B trên 100 trường hợp bệnh nhân tăng huyết áp nguyên phát và 100 người khỏe mạnh đối chứng được, kết quả cho thấy sự phân bố HLA- A và HLA - B giữa nhóm chứng và nhóm bệnh không khác nhau có ý nghĩa thống kê, điều đó chỉ ra rằng người da đen mang HLA- A hoặc HLA - B có thể không liên quan đến bệnh tăng huyết áp nguyên phát. Năm 1992 Gerbase M.[8] và cộng sự cũng dùng phương pháp trên để phân tích sự phân bố của HLA- A, B, DR ở 89 bệnh nhân người da trắng ở Brazil, kết quả cho thấy có dấu hiệu nhạy cảm di truyền của bệnh tăng huyết áp nguyên phát khi tìm thấy tần số cao hơn của gen HLA- DR4. Năm 1998 Gerbase M.[9] nghiên cứu sự phân bố các kháng nguyên HLA trên 33 trường hợp tăng huyết áp nguyên phát ác tính ở người Brazil da trắng và người lai da trắng da đen cho thấy, những người Brazil lai trắng - đen mang kháng nguyên HLA- DR3 có liên quan mật thiết với bệnh.
Cùng với sự phát triển của kỹ thuật sinh học phân tử, nhiều nghiên cứu phân bố các alen HLA ở những quần thể khác nhau ở các khu vực khác nhau liên quan đến bệnh tăng huyết áp nguyên phát là khác nhau. Vidan Jeras B. và cộng sự [23] nghiên cứu phân bố các alen HLA liên quan đến bệnh tăng huyết áp nguyên phát ở quần thể người Slovenia cho thấy, những người mang alen HLA-DRB1*0101/2, DQB1*0501/2, DQA1*0102 có thể làm tăng nguy cơ tăng huyết áp nguyên phát, như vậy có thể các alen này gia tăng nguy cơ mắc bệnh, còn ở những những người mang các alen HLA-DRB1*1601/2, DQB1*0502, DQA1*0102 hoặc DRB3* có thể làm
giảm nguy cơ mắc bệnh tăng huyết áp nguyên phát, có thể đây là các alen có khả năng bảo vệ.
Năm 2005 Zabay J.M. và cộng sự [29] trong một nghiên cứu phân bố các alen HLA-B, DRB củaquần thể trên cùng một chủng tộc ở đảo Balearic, Majorca của Tây Ban Nha ở 110 bệnh nhân tăng huyết áp nguyên phát cùng 107 người khỏe mạnh ở nhóm chứng, kết quả cho thấy những người mang alen HLA-DRB3*0202 tương quan mật thiết với bệnh tăng huyết áp nguyên phát (OR = 1,79, p = 0,03); những người mang alen HLA-DRB4*01 thường không bị mắc bệnh tăng huyết áp nguyên phát (OR = 0,56, p = 0,04). Như vậy, alen HLA-DRB3*0202 có thể là một gen tăng nguy cơ cho bệnh này, ngược lại, alen HLA-DRB4 01 có thể là gen giúp giảm nguy cơ với bệnh tăng huyết áp nguyên phát. Gu X.X.[10], sử dụng kỹ thuật PCR- SSO nghiên cứu 120 trường hợp bệnh nhân tăng huyết áp nguyên phát và 168 người khỏe mạnh ở nhóm chứng tại Bỉ về phân bố HLA- DRB, DPB1, kết quả đã không tìm thấy sự khác biệt tần suất DPB1, HLA- DRB giữa hai nhóm có ý nghĩa thống kê, nghiên cứu đã kết luận HLA-DRB, DPB1 không liên quan với bệnh tăng huyết áp nguyên phát.
Người Hán ở Trung Quốc đều thuộc chủng tộc da vàng nhưng có đặc trưng cư trú riêng biệt ở 2 miền Nam và Bắc, các yếu tố di truyền cũng có thể khác biệt nhau. Năm 1998, Sun Ningling [20] sử dụng kỹ thuật PCR- SSP nghiên cứu sự phân bố các alen HLA-DQA1 ở người Hán sống ở phía bắc sông Hoàng Hà trên 52 trường hợp bệnh nhân tăng huyết áp lịch sử gia đình và 86 người khỏe mạnh ở nhóm chứng. Kết quả cho thấy tần suất mang alen HLA-DQA1*0302 trong nhóm bệnh cao hơn đáng kể, trong khi đó mang alen HLA- DQA1*0103 có tần suất cao hơn ở nhóm chứng nhóm bình thường. Như vậy, có thể mang alen HLA- DQA1*0302 có thể là yếu tố nguy cơ cho bệnh tăng huyết áp nguyên phát, alen HLA-DQQA1*0103 có thể là yếu tố bảo vệ. Nghiên cứu năm 2001 của Shen Naiyu [19] cùng ở phía bắc sông Hoàng Hà trên quần thể người Hán bằng cách sử dụng cùng một phương pháp của Sun Ningling về mối liên quan giữa HLA- DQA1 với tăng huyết áp nguyên phát, kết quả cho thấy mang alen HLA-DQA1*0301 và tăng huyết áp nguyên phát có mối liên quan, đồng thời cũng chứng minh được người mang alen HLA-DQA1*0103 có thể giảm nguy cơ mắc bệnh tăng huyết áp tương tự như nghiên cứu của Sun Ningling. Trong một nghiên cứu trên người Hán ở phía nam năm 2004 của Hu Dachun [11] bằng cách sử dụng cùng một phương pháp PCR-SSP để phân tích sự phân bố các alen HLA- DQA1 trên 83 bệnh nhân và 91 người khỏe mạnh tại tỉnh Vân Nam, kết quả cho thấy ở bệnh nhân thì tần suất mang HLA-DQA1*0302 là 0,128 cao hơn so với nhóm đối chứng (0.011), χ2 = 19,409, p <0,01; và tần suất mang HLA-DQA1*0201 ở nhóm bệnh là 0,061, thấp hơn so với nhóm chứng (0,170), χ2 = 9,876, p <0,05); như vậy có thể thấy rằng có sự khác biệt giữa 2 quần thể người Hán ở phía bắc và phía nam Trung Quốc. Mang alen HLA-DQA1*0302 có thể xem là liên quan với bệnh tăng huyết áp nguyên phát, kết quả đó tương tự như nghiên cứu của Sun Ningling ở người Hán phía Bắc, trong khi đó, mang alen HLA-DQA1*0201 có thể có tác dụng bảo vệ
khỏi mắc bệnh, kết quả này khác với nghiên cứu của Sun Ningling và Shen Naiyu. Kết quả nghiên cứu này có thể doVân Nam nằm ở biên cương phía nam, nhiều dân tộc thiểu số chung sống, người hán ở Vân Nam có tổ tiên đến từ khắp nơi trên đất nước Trung Quốc và hiện tượng kết hôn với người dân tộc thiểu số, do đó phân bố các alen hệ HLA có đặc trưng riêng.
Một nghiên cứu bệnh chứng vào năm 1997 của Sun Ningling trên người Hán về sự phân bố các alen HLA-DRB1 [21] bằng kỹ thuật PCR- SSP, kết quả cho thấy alen HLA-DRB1*1501/2 có tần suất cao ở bệnh nhân tăng huyết áp nguyên phát, ngược lại alen HLA-DRB1*0901 có tầnsuất cao hơn ở nhóm chứng. Nghiên cứu năm 2004 của Ye Jianchun [27] về phân bố các alenHLA- DRB1 bằng cách sử dụng kỹ thuật tương tự trên bệnh nhân tăng huyết áp ở người Hán tỉnh Vân Nam cũng cho kết quả tương tự. Những nghiên cứu mối liên quan giữa HLA và phì đại thất trái trong tăng huyết áp nguyên phát đã giải thích một số cơ chế bệnh sinh của phì đại thất trái. Ở những bệnh nhân tăng huyết áp, khỏang 1/3 sẽ xuất hiện phì đại tâm thất trái (LVH: Left ventricular hypertrophy). Chúng ta đều biết, LVH là biểu hiện quan trọng của tăng huyết áp trên cơ quan đích, đồng thời liên quan chặt chẽ với bệnh mạch vành, suy tim, đột quỵ và các bệnh tim mạch khác [6], [22], [28]. Tuy nhiên, cơ chế của LVH phức tạp hơn, cơ chế chính xác chưa được biết rõ ràng. Trong những năm gần đây, LVH được xem là kết quả của tình trạng quá tải của tâm thất trái để thích ứng với áp lực quá tải. Nhưng nhiều nghiên cứu quan sát thấy rằng mối quan hệ giữa huyết áp và kích thước thất trái không phải là chặt chẽ, sự thay đổi huyết áp động mạch với mức độ phì đại thất trái không phải là hoàn toàn tương ứng với nhau. Vì thế, cho đến nay nhiều tác giả cho rằng LVH liên quan đến độ tuổi, giới tính, cân nặng, chủng tộc, yếu tố di truyền, mức độ kháng insulin và mức độ tăng huyết áp [14]. Nói về các yếu tố di truyền, các tác giả nước ngoài đã báo cáo mối liên quan giữa HLA với LVH, họ chỉ ra rằng HLA có thể được tham gia vào cơ chế bệnh sinh của LVH. Nghiên cứu năm 2001 của Emmanuel J, Diamantopoulos [6] trên 158 trường hợp mới mắc tăng huyết áp nguyên phát của Athens (Hy lạp) xem HLA có phải là một trong những yếu tố liên quan đến thay đổi cấu trúc của tim mạch hay không bằng phương pháp đo khối lượng thất trái (LVM: left ventricular mass) bằng siêu âm và tính tỷ lệ LVM/chiều cao (LVM/h), độ dày lớp nội mạc động mạch cảnh (IMT: Intimamedia thickness), xác định sự phân bố các alen HLA bằng kỹ thuật PCR. Kết quả phát hiện thấy, bệnh nhân tăng huyết áp nguyên phát mang HLA-DQ7, HLA-DR11 có tỷ lệ LVM/h cao hơn người không mang các locus này, trong khi những bệnh nhân mang HLA-B51 có LVM/h thấp hơn so với người không mang locus này. Như vậy HLA-DQ7, HLA-DR11 có thể là yếu tố nguy cơ cho LVH, ngược lại HLA-B51 có thể có hiệu quả bảo vệ khỏi LVH, từ đó có thể suy đoán HLA có thể được liên quan với cơ chế bệnh sinh của bệnh tăng huyết áp có LVH. Năm 2003, một nghiên cứu khác của Vlachonikolis IG [24] trên người Athens với phương pháp tương tự như trên với 61 người có huyết áp bình thường, 153 bệnh nhân tăng huyết áp nguyên phát nhưng chia làm 3 nhóm: Nhóm 1: Tăng huyết áp độ I; nhóm 2: Tăng huyết áp độ II và nhóm 3: Tăng huyết áp độ III. Mục tiêu của nghiên cứu để xác định mối liên quan giữa kháng nguyên HLA với sự thay đổi cấu trúc tim, mạch thông qua phản ánh của LVM và IMT. Kết quả cho thấy tần suất mang HLA-DR11 ở nhóm thứ ba có LVM/h cao hơn người bình thường, nhưng sự kết hợp này không được tìm thấy ở các nhóm đầu tiên và nhóm thứ hai, điều này có thể chứng minh HLA-DR11 có thể liên quan đến LVH, hay có
thể suy đoán HLA liên quan đến mức độ huyết áp động mạch và HLA có thể là một yếu tố thúc đẩy thay đổi cấu trúc tim, mạch trong tăng huyết áp. Một số các nghiên cứu ở Mỹ và Trung Quốc cho rằng, người mang alen HLA-B12, HLA- B35, HLA-DRB1*1501/2 rất dễ bị cao huyết áp hay các hội chúng liên quan đến cholesterol máu hay cao nồng độ mỡ trong máu. Ngược lại, những người mang alen HLA-DRB*0901 thì khó có khả năng mắc bệnh cao huyết áp. Vấn đề này có lẽ liên hệ đến quá trình chuyển hóa mỡ trong cơ thể [2], [23].
Nói tóm lại, hầu hết các kết quả nghiên cứu đều cho rằng có mối liên quan giữa HLA với bệnh tăng huyết áp nguyên phát, rất tiếc là chưa có nghiên cứu nào ở trong nước báo cáo về vấn đề này. Cùng với sự phát triển của kỹ thuật sinh học phân tử, chúng ta hy vọng có những nghiên cứu trong nước được thực hiện trong lĩnh vực này. Có như vậy chúng ta mới có thể cung cấp cho thầy thuốc lâm sàng và bệnh nhân mắc bệnh tăng huyết áp nguyên phát những bằng chứng về sinh học phân tử để phân loại lâm sàng, chẩn đoán, phòng ngừa biến chứng… trên những người mang các kháng nguyên HLA khác nhau.
TÀI LIỆU THAM KHẢO
1. Andrew J, George T (1995), “Disease usceptibility, transplantation and the MHC”, Immunology Today, 5(16), 209-211.
2. Trần Đình Bình (2005), HLA-Nghiên cứu và ứng dụng, Kỹ thuật PCR, Nhà xuất bản Y học, Hà Nội.
3. Trần Đình Bình, Linlin Wang, Qingwen Shan, Lin Weixiong (2005), “Mối liên hệ giữa các allele HLA-DQA1 với cảm nhiễm Helicobacter pylori ở trẻ em dân tộc Hán, Choang, Mộc lao La thành, Quảng tây Trung quốc và trẻ em dân tộc Kinh ở Huế”, Tạp chí Y học thực hành, Số 521, 80-86.
4. Trần Đình Bình, Ngô Viết Quỳnh Trâm, Huỳnh Thị Hải Đường, Lê Phi Long (2011), “Nghiên cứu phân bố HLA-DQA1 ở người và người mắc ung thư gan, ung thư phổi tại khu vực Bình Trị Thiên”, Tạp chí Y dược học, Số 1, 111-118.
5. Cristina Barlassina, Chiara Lanzani, Paolo Manunta et al (2002), “Genetics of essential hypertension: From families to genes”, J Am Soc Nephrol, 13, S155-S164.
6. Emmanuel J., Diamantopoulos Emmanuel A et al (2001). “Association of specific HLA phenotypes with left ventricular mass and carotid intimamedia thickness in hypertensives”, Am J hypertension, 14, 632-636.
7. Fan Lian, Zhou Guangyan (1999), “Renlei jiyinzu MHC cexu jiqi mianyixue yiyi”, Shanghai mianyixue zazhi, 19(6), 321-322.
8. Gerbase DeLima M (1992). “Essential hypertension and histocompatibility antigens. An association study”. Hypertension, 19, 400-402.
9. Gerbase DeLima M., Paiva Human RL (1998), “Leukocyte antigens and malignant essential hypertension”, J Hypertens, 11(6 Pt 1), 729-731.
10 Gu XX., Spaepen M., Raeymaekers P. et al (1995), “Lack of association between HLA class II polymorphisms and essential hypertension in a Belgian population”, J Hum Hypertens, 9(7), 553-555.
11. Hu Dachun, Ye Jianchun, Chen Aihua et al (2004), “Yunnan Hanzu yuanfaxing gaoxueya yu dengwei jiyin de xiangguanxing yanjiu”, Zhongguo xinxueguan zazhi, 6, 9(3), 157-159.
12. Jan Klein, Akie Sato (2000), “The HLA system: First of two parts”, N Engl J Med, 343(10), 702-709.
13. Johnson J (1981). “Histocompatibility antigens in black patients with essential hypertension”, Circulation, 64, 1042-1044.
14. Liu Guozhang, Dang Aimin (1998), “Gaoxueya zuoshi feihou de fasheng jizhi, zhenduan ji zhiliao”, Zhongguo xunhuan zazhi, 1 23.
15. Liu Yahe, Lu Fenghua, Zhou Guangyan et al (1996), “MHC-II lei jiyin qidongzi jiqi duotaixing shunshizuoyong yuanjian DNAyanjiu jinzhan”, Guowai yixue, Mianyixue fence 19(6), 281-284.
16. Low B, Schersten B, Sarter G et al (1975). “HLA8 and W15 in diabetes mellitus and essential hypertension”. Lancet, 1, 695.
17. Olerup O., Aldener A., Fogdell A. (1993), “HLA-DQB1 and HLA-DQA1 typing by PCR amplification with sequence specific primers (PCR-SSP) in 2 hours [J]. Tissue Antigens, 41(3), 119-134.
18. Olerup O. (1994), “HLA-B27 typing by a group specific PCR amplification [J]. Tissue Antigens, 43(4), 253-256.
19. Shen Naiyu, Yan Zheng, He Peiying et al (2001), “Yuanfaxing gaoxueya he dongmai yinhuaxing naogengsi ji qiangxixing naogengsi huanzhe de HLA-DQA1 yichuan yiganxing”, Zhonghua yixue zazhi, 81(6), 352-355.
20. Sun Ningling, Yan Wenying, Yan Zheng et al (1998), “HLA-DQA1dengwei jiyin yu yuanfaxing gaoxueya xiangguanxing yanjiu”, 15(5), 288-290.
21. Sun Ningling, Yan Wenying, Wang Shenwu et al (1997), “Yuanfaxing gaoxueya yu HLA-DRB dengwei jiyin xiangguanxing yanjiu”, Beijing yixue daxue zazhi, 29(4), 348-351.
22. Verdecchia P, Schillaci G, Borgioni C et al, “Adverse prognostic significane of geometric remodelingof the left ventricle in hypertension patients with normal left ventricular mass”. J Am Coll Cardiol, 25, 871-878.
23. Vidan Jeras B., Gregoric A., Jurca B. et al (2000), “Possible influence of genes located on chromosome 6 within or near to the major histocompatibility complex on development of essential hypertension”, Pflugers Arch, 439(3 Suppl), R60-62.
24. Vlachonikolis IG, Tarassi KE, Chatzis NA et al (2003), “HLA phenotypes as promoters of cardiovascular remodelling in subjects with arterial hypertension”, J Hum Hypertens, 17(1), 63-68.
25. Wang Linlin, Tran Dinh Binh, Lin Weixiong, Jiang Haixing, Shan Qing-wen, Xie Xiangzhi, Liang Danmei (2004), “The association of HLA-DQA1 polymorphism with Helicobacter pylori infection in children of Guangxi Luocheng Han, Zhuang and Mulao nationalities”, Guangxi Medical Journal, Vol 26, No6, 778-781.
26. Wang Linlin, Tran Dinh Binh, Lin Weixiong, Jiang Haixing, Shan Qing-wen, Xie Xiangzhi, Liang Danmei (2004), “Association of HLA-DQA1 loci with Helicobacter pylori infection in children of Guangxi Zhuang, Mulao nationalities, China and central Jing nationality, Vietnam”, Chinese Journal of Pediatrics, Vol 42, No8, 577-580.
27. Ye Jianchun, Hu Dachun, Chen Aihua et al (2004), “Yunnan Hanzu yuanfaxing gaoxueya yu dengwei jiyin de xiangguanxing”, Zhonghua yixue yichuanxue zazhi, 21(3), 286-287.
28. Yu LH, Ulf de F, Debra A, et al (1994), “Genetic and environmental influence on blood pressure in elderly twins”, Hypertension, 1994, 24(6), 663-670.
29. Zabay JM, Marco J., Soler J. et al (2005), “Association of HLADRB3*0202 and serum IgG antibodies to Chlamydia pneumoniaewith essential hypertension in a highly homogeneous population from Majorca (Balearic Islands Spain)” Human Hypertension, 19, 615-622.